أسيتات إبتيفيباتيد
مقدمة موجزة:
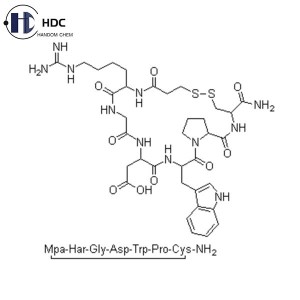
إبتيفيباتيد هو سباعي ببتيد حلقي صناعي، وهو مضاد لمستقبلات الجليكوبروتين IIb/IIIa، ومضاد لمستقبلات الفيبرينوجين، وله تأثيرات مضادة لتجمع الصفائح الدموية. وظيفته الرئيسية هي منع تجمع الصفائح الدموية، ويمكن استخدامه لعلاج الجلطات في متلازمة الشريان التاجي الحادة.
مواصفات أسيتات إبتيفيباتيد الخاصة بنا:
| عناصر الاختبار | تحديد |
| مميزة | هذا المنتج عبارة عن مسحوق غير متبلور أبيض أو أبيض مائل للصفرة، عديم الرائحة وممتص للرطوبة. يذوب بسهولة في الماء، ويكاد يكون غير قابل للذوبان في الكلوروفورم أو الأسيتون. |
| الدوران المحدد | تم حسابها على أساس المنتج الخالي من حمض الخليك واللامائي، والدوران النوعي يتراوح بين -52.0 درجة و-56.0 درجة |
| تعريف | (1) يتمتع هذا المنتج بأقصى قدر من الامتصاص عند أطوال موجية تبلغ 220 نانومتر و280 نانومتر |
| (2) يجب أن يكون زمن الاحتفاظ بالذروة الرئيسية لمحلول الاختبار متوافقًا مع زمن الاحتفاظ بالذروة الرئيسية لمحلول المرجع | |
| (3) يجب أن يكون طيف امتصاص الأشعة تحت الحمراء لهذا المنتج متوافقًا مع طيف المادة المرجعية إبتيفيباتيد | |
| (4) يجب أن يكون الوزن الجزيئي للطيف الكتلي 832±1Da | |
| وضوح المحلول واللون | يجب أن يكون المحلول صافيًا وعديم اللون. إذا كان عكرًا، فلا ينبغي أن يكون أغمق من محلول العكارة القياسي رقم 2؛ وإذا كان ملونًا، فلا ينبغي أن يكون أغمق من محلول القياس اللوني القياسي الأصفر رقم 1 أو الأصفر المخضر رقم 1. |
| حموضة | يجب أن تكون قيمة الرقم الهيدروجيني بين 3.5 و 5.5 |
| رُطُوبَة | لا يزيد عن 5.0% |
| حمض الخليك | لا يزيد عن 12.0% |
| حمض ثلاثي فلورو الأسيتيك | لا يزيد عن 0.5% |
| المذيبات المتبقية | الميثانول: لا يزيد عن 0.3% |
| الأسيتونتريل: لا يزيد عن 0.041% | |
| N,N-ثنائي ميثيل فورماميد: لا يزيد عن 0.088% | |
| نسبة الأحماض الأمينية | حمض الأسبارتيك (Asp): 0.8 ~ 1.2 |
| الهومورجينين (H-HomoArg-OH): 0.8 ~ 1.2 | |
| الجلايسين (جلي): 0.8 ~ 1.2 | |
| برولين (برو): 0.8 ~ 1.2 | |
| التربتوفان (Trp): 0.8 ~ 1.2 | |
| السيستين (Cys): 0.8 ~ 1.2 | |
| المواد ذات الصلة | يجب ألا تزيد مساحة ذروة الشوائب A والشوائب H عن 1.5 مرة (0.3%) من مساحة الذروة الرئيسية لمحلول التحكم. يجب ألا تزيد مساحة ذروة الشوائب B، والشوائب C، والشوائب D، والشوائب E، مضروبة في معامل التصحيح (1.23)، والشوائب F (0.86)، والشوائب G (1.24) عن مساحة الذروة الرئيسية لمحلول التحكم (0.2%). يجب ألا تزيد مساحة ذروة الشوائب الأخرى المجهولة عن مساحة الذروة الرئيسية لمحلول التحكم (0.2%)، ويجب ألا يزيد مجموع مساحات ذروة كل شوائب عن 5 أضعاف مساحة الذروة الرئيسية لمحلول التحكم (1.0%). |
| البوليمر | يجب ألا يتجاوز زمن الاحتفاظ بكل مكون أقل من زمن الاحتفاظ بشائبة إبتيفباتيد G 0.5%، ويجب ألا يتجاوز إجمالي الشوائب 1.0% (بما في ذلك الشوائب G) |
| ملح الزرنيخ | لا يزيد عن 0.00015% |
| السموم البكتيرية الداخلية | يجب أن تكون كمية السموم الداخلية الموجودة في كل 1 ملغ من إبتيفيباتيد أقل من 0.2 EU |
| الحدود الميكروبية | إجمالي عدد الميكروبات الهوائية: NMT 1000 CFU/g |
| إجمالي عدد الخميرة والعفن: 100 وحدة تشكيل مستعمرة/جم | |
| البكتيريا سلبية الجرام المقاومة للصفراء | |
| فحص | تم حساب هذا المنتج على أنه خالٍ من حمض الأسيتيك واللامائي، ويحتوي على إيبتيفباتيد بنسبة 98.0% إلى 102.0% |
دواعي الاستعمال:
هذا المنتج مناسب للمرضى الذين يعانون من متلازمة الشريان التاجي، بغض النظر عما إذا كانوا يعانون من أعراض الشريان التاجي الحادة (الذبحة الصدرية غير المستقرة واحتشاء عضلة القلب بدون موجة Q)، وكذلك المرضى الذين يعانون من أعراض الشريان التاجي الحادة ويتناولون العلاج الدوائي.
التغليف:
1 جرام/زجاجة، 5 جرام/زجاجة، 10 جرام/زجاجة، 30 جرام/زجاجة، 50 جرام/زجاجة أو 100 جرام/زجاجة.
ظروف التخزين:
يُخزن في عبوات أصلية غير مفتوحة في مكان بارد وجاف قبل الاستخدام؛ يُحفظ بعيدًا عن أشعة الشمس المباشرة والحرارة والرطوبة؛ يُحفظ في درجة حرارة تتراوح من 2 إلى 8 درجات مئوية للتخزين قصير الأمد، -20 درجة مئوية ± 5 درجات مئوية للتخزين طويل الأمد.
مدة الصلاحية:
24 شهرًا إذا تم تخزينها في ظل الظروف المذكورة أعلاه.